Differentialtherapie der Osteoporose in der Praxis
erschienen in: Seminar Hausarzt Praxis 1, 2000
Die Therapie richtet sich nach der Geschwindigkeit des knöchernen Masseverlustes
Die Osteoporose, die von der WHO mittlerweile in die Liste der weltweit zehn bedeutendsten Krankheiten aufgenommen wurde, betrifft häufig Frauen nach den Wechseljahren u.a. aufgrund des Wegfalls der Östrogene aber auch durch eine chronische Unterversorgung mit Calcium und Vitamin D3. Folgen sind vor allem Brüche der Unterarme (Radiusfraktur, oft erster Hinweis auf eine beginnende Osteoporose), Wirbelkörper und des Oberschenkelhalses. Gerade die Wirbelkörpereinbrüche sind für die chronischen Osteoporoseschmerzen verantwortlich, während die Oberschenkelhalsfrakturen oft zur Invalidität und bei den meist schon älteren Patienten nicht selten zum Tod führen. Die beste Therapie ist die Prophylaxe – das Vermeiden von Knochenverlusten. Ansonsten steht heute eine breite Palette an Medikamenten zur Verfügung, die entweder den Knochenabbau bremsen oder den knöchernen „Wiederaufbau“ stimulieren. Die Entscheidung welche Substanzen für welche Patienten am geeignetsten sind muß sich heute daran orientieren, ob der Knochenmasseverlust schnell oder langsam erfolgt.
Derzeit existieren zwei gebräuchliche Definitionen der Osteoporose. Die Konsenskonferenz 1993 definierte die Osteoporose als systemische Erkrankung des Skelettes, die aufgrund erhöhter Knochenmasseverluste zu einer erniedrigten Knochenmasse und zu Störungen in der knöchernen Mikroarchitektur führt, was ein erhöhtes Frakturrisiko bedingt. Darin sind drei Aspekte enthalten: Knochenmasse (Quantität), Knochenstruktur (Qualität) und Knochenverlust (Dynamik). Die aktuelle WHO-Definition definiert die Osteoporose hingegen nur über die Quantität auf Basis der gemessenen Knochendichte bezogen auf den T-Score, also die mittlere Knochendichte junger, gesunder Frauen oder Männer (peak-bone-mass). Als normal werden Werte bis – 1 SD angesehen, Knochendichtewerte zwischen – 1 SD und – 2,5 SD werden als Osteopenie bezeichnet, eine Osteoporose besteht definitionsgemäß ab Knochendichtewerten unterhalb – 2,5 SD. Das Problem hierbei ist, dass die individuelle Höhe der peak-bone-mass wie z.B. auch die Körpergröße stark streut und bei niedrigen Knochendichtewerten nicht unterschieden werden kann zwischen einer durch vorangegangenen Knochenabbau bedingten Osteopenie bzw. Osteoporose oder einer auf lediglich niedrigerem Niveau entwickelten peak-bone-mass. Nur der osteoporotische Knochenabbau führt zwingend zu Störungen der knöchernen Mikroarchitektur, während eine genetisch und/oder entwicklungs- bzw. konstitutionsbedingt unterdurchschnittlich ausgebildete peak-bone-mass durchaus mit regelrechter Mikroarchitektur einhergehen kann. Das Frakturrisiko, das neben der Knochendichte von vielen Faktoren, insbesondere von der Integrität der knöchernen Strukturen bestimmt wird, muss dann nicht unbedingt erhöht sein. Die aus dem erhöhten Abbau resultierenden Defekte in der Knochenstruktur sind aber nur mit speziellen bildgebenden Verfahren zu beurteilen, welche bisher nur ausnahmsweise zur Verfügung stehen.
Hoher bzw. niedriger Knochenumsatz als Basis der Therapieentscheidung
Ein hoher Knochenumsatz entspricht einem schnellen Knochenverlust, ein langsamer Knochenumsatz einem langsamen Knochenverlust. Bei einem schnellen Knochenverlust, auch Fast-Bone-Loss genannt, erhöht sich das Frakturrisiko statistisch um das Vier- bis Fünffache. Diese Einteilung in Fast- und Slow-Loser löst die bisherige Klassifikation in Typ-I- und Typ-II-Osteoporose ab, die eigentlich nur noch bedeutsam für den unterschiedlichen Knochenabbau in Spongiosa und Kompakta ist. Bei der vor allem peri- und frühpostmenopausal auftretenden Typ-I-Osteoporose findet sich vorwiegend ein Spongiosaverlust, während bei der senilen (Typ-II)-Osteoporose noch der Kompaktaverlust hinzukommt. Dies passt zu den klinischen Beobachtungen, dass Frauen mit Wirbelkörperfrakturen, bei denen zunächst die Spongiosa reduziert ist, meist jünger sind als Frauen mit Schenkelhalsfrakturen, bei denen die Knochenbrüchigkeit durch den zusätzlichen Kompaktaverlust ansteigt.
Fast- und Slow-Loser
- Der Knochenverlust bei Fast-Loser-Patienten ist definiert als ein Spongiosaverlust von mehr als 3 % im Jahr. Ob ein Patient ein Fast-Loser ist kann z.B. mit Hilfe biochemisch gemessener Serum- und Urinmarker bestimmt werden. In der Praxis sind dabei die Serum-Parameter den Urin-Parametern vorzuziehen, da das Urinsammeln für manche Patienten doch sehr kompliziert ist. Auch für die Serum-Parameter (z.B. Sialo-Proteine, b-Cross-Laps) müssen die Entnahme- und Transportvorschriften genau eingehalten werden. Außerdem ist es empfehlenswert, nicht auf einer einzigen Messung aufzubauen, sondern wenigstens zwei bis drei Bestimmungen im Abstand von zwei bis drei Wochen vorzunehmen, da im Einzelfall doch große Schwankungen existieren.
- In der Praxis kann ein Fast-Bone-Loss angenommen werden, wenn innerhalb eines Jahres mehr als zwei neue Wirbelkörperfrakturen aufgetreten sind und/oder der Patient mehr als fünf Zentimeter seiner Körpergröße verloren hat. Es empfiehlt sich allerdings nicht unbedingt, die Ausprägung dieser Zeichen für eine Therapieentscheidung abzuwarten.
- Am genausten ist die Beurteilung mittels zweier aufeinanderfolgender Knochendichtemessungen. Wichtig hierfür ist aber eine möglichst gute Reproduzierbarkeit der verwendeten Densitometriegeräte von unter einem Prozent! Zum Beispiel ist bei vielen herkömmlichen Geräten, die in Praxi eine Reproduzierbarkeit von zwei Prozent haben, eine Kontrollmessung vor Ablauf von zwei Jahren sinnlos, weil keine zuverlässige Aussage über das Ausmaß des Knochenverlustes gemacht werden kann. Bei Geräten mit einer Reproduzierbarkeit von deutlich unter einem Prozent kann anhand einer zweiten Dichtemessung jedoch bereits nach wenigen Monaten festgestellt werden, ob es sich bei dem Patienten um einen Fast- oder Slow-Loser handelt bzw. ob der Patient auf das eingenommene Medikament reagiert hat.
Knochendichtemessverfahren und ihre Aussagekraft
Nach Abklärung, ob es sich um Non-Loser, also Patienten mit stabilem Skelett, Slow-Loser mit einem Verlust an Spongiosamasse von einem bis drei Prozent im Jahr oder Fast-Loser mit mehr als drei Prozent Spongiosaverlust pro Jahr handelt, können die entsprechenden Medikamente eingesetzt werden. Mit der am weitest verbreiteten Densitometrie-Methode der DXA (Dual X-Ray-Absorptiometrie) kann nicht zwischen Spongiosa und Kompakta unterschieden werden, jedoch aufgrund des höheren Spongiosaanteils an der LWS die Spongiosamasse bzw. am Schenkelhals aufgrund des höheren Kompaktaanteils die Kompaktamasse annäherungsweise beurteilt werden. QCT-Messungen an der LWS können Spongiosa und Kompakta selektiv messen, während Ultraschallmessungen am Calcaneus, an der Tibia oder an den Fingern weder zwischen Spongiosa und Kompakta unterscheiden noch Aussagen zum Mineralgehalt des Knochens machen können (gemessen werden Schallgeschwindigkeiten und Schallabschwächungen) und eigentlich nur ein Fakturrisiko angeben. Ultraschallmessungen der Hautdicke am Oberarm sind völlig ungeeignet, Aussagen über die Knochenmasse zu machen! Nur die bildgebende, periphere, quantitative Computertomographie am Radius und an der Tibia kann derzeit volumetrische Knochendichten in mg/cm3 selektiv für Spongiosa und Kortikalis messen und bei sehr guter Reproduzierbarkeit gleichzeitig auch eine Darstellung der Knochenstrukturen leisten, was für eine optimale Therapieentscheidung hilfreich ist.
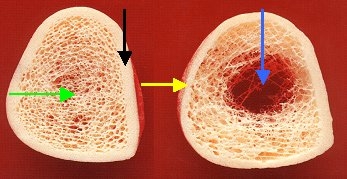
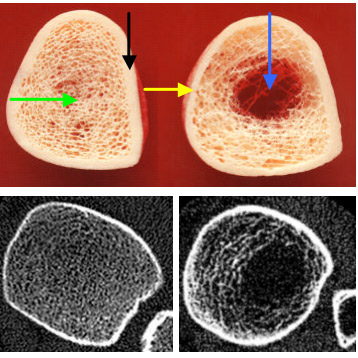
Bild oben – Knochenpräparat: links gesunder Knochen (grüner Pfeil: Spongiosa, schwarzer Pfeil: Kompakta), rechts osteoporotischer Knochen mit fortgeschrittenem Trabekelabbau (blauer Pfeil) und Verschmälerung der Kompakta (gelber Pfeil).
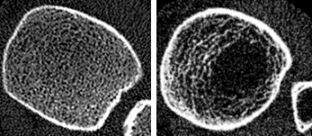
Bilder Mitte: entsprechende Bilder, wie sie mit der von uns verwendeten hochauflösenden, bildgebenden, peripheren, quantitativen Computertomographie (Densiscan 1000, Scanco Medical AG, Zürich), gewonnen werden, die neben der selektiven Messung der trabekulären und kortikalen Knochendichten auch die Strukturdarstellung des Knochens ermöglicht (Auflösung 0,2 mm).
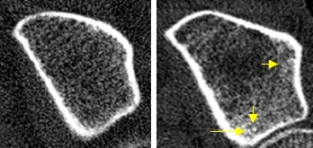
Bilder unten: Zwei Patientinnen mit gleicher Spongiosadichte (links: 191mg/cm3, T-Score = – 1,3 SD, rechts: 187mg/cm3, T-Score = – 1,4 SD, entsprechend einer Osteopenie nach WHO-Def.). Die trabekuläre Mikroarchitektur links ist noch weitgehend erhalten, während der Knochen rechts einen massiven Abbau der Trabekel und ausgeprägte Verdichtungen (Mikrokallusbildungen, gelbe Pfeile), welche die Spongiosadichte deutlich zu hoch ausfallen lassen, zeigt. Trotz gleicher Spongiosadichten ist links wohl nur von einer unterdurchschnittlich ausgebildeten peak-bone-mass auszugehen, während die Osteoporose bei der rechten Patientin geradezu ins Auge springt. Erst die Strukturdarstellung gibt hier Aufschluss!
Baustein des Knochens und „Transportvehikel“: Calcium plus Vitamin D3
Knochen besteht zu einem großen Teil aus Calciummineralsalzen. Da zwischen fünf bis zehn Prozent des gesamten Skelettes jährlich erneuert werden, braucht der Körper auch ständig Nachschub an Baumaterial, sprich Calcium. So einfach ist das! Der tägliche Calciumbedarf beträgt 1200 – 1500 mg. 1200 mg entsprechen ungefähr einem Liter Milch oder 100 g Hartkäse. Auch manche Mineralwässer sind reich an Calcium, daher sollte auf den Calciumgehalt auf dem Etikett geachtet werden. Unsere Erfahrungen anhand von Ernährungsfragebögen zeigen, dass die tägliche Calciumzufuhr häufig nur zwischen 600 und 800 mg beträgt! Somit ist eine zusätzliche Calciumsubstitution mittels Calciumpräparaten bei gefährdeten und erst recht bei osteoporotischen Patienten immer sinnvoll bzw. notwendig. Neuere Untersuchungen geben Hinweise darauf, dass die Substitution in Form von Kautabletten effektiver sein könnte als mit Brausetabletten und dass Calciumcarbonat, die bei uns häufigste Form von Calciumpräparaten, zwar nicht so gut wie organisch gebundenes Calcium in Form von Calciumcitrat aber besser als Calciumgluconat resorbiert wird. Generell ist eine fraktionierte Einnahme über den Tag verteilt oder zumindest 2 x 500 mg der Einmalgabe von 1000 mg vorzuziehen.
Natives Vitamin D3 (Cholecalciferol) unterstützt die Resorption des Calciums im Darm und den Transport bzw. Einbau in den Knochen und sollte daher möglichst und bei älteren Menschen über 60 Jahren generell zusätzlich zu Calcium gegeben werden. Wegen der langen Halbwertszeit besteht eine gewisse Gefahr der Überdosierung, daher sollte die tägliche Dosis 1000 I.E. in der Regel nicht überschreiten. Erkennen lässt sich eine solche Überdosierung durch eine vermehrte Urin-Calcium-Ausscheidung bzw. eine Hypercalciämie.
Sonstige verfügbare Osteoporose-Medikamente
Neben der Basistherapie mit Calcium und Vitamin D3 sollte sich die Therapie der Osteoporose vor allem am Knochenumsatz orientieren. Bei Slow-Losern und Non-Losern mit nicht allzu sehr erniedrigten Knochendichten sollten vor allem Substanzen eingesetzt werden, die den knöchernen „Wiederaufbau“ stimulieren können. Dafür kommen in Frage:
- Fluoride
- D-Hormon-Metabolite wie Alphacalcidol oder Calcitriol
- Östrogene (in höherer Dosierung)
Bei Fast-Losern müssen vor allem antiresorptiv wirksame Substanzen eingesetzt werden, die den erhöhten Knochenmasseverlust bremsen bzw. stoppen können, wie:
- Östrogene
- SERM ’s (selektive Östrogen-Rezeptor-Modulatoren)
- Calcitonin
- Bisphosphonate
- D-Hormon-Metabolite
Grundsätzlich gilt, dass ohne klar begründete Indikation außer Calcium-/Vitamin D3 keine Medikamente wie Östrogene, SERM’s, Östrogen-Analoga, Bisphosphonate, Calcitonin, Fluoride, Anabolika oder D-Hormon-Metabolite verordnet werden sollten!
Basistherapie ist immer Calcium plus Vitamin D3
Praktisch jede Osteoporosetherapie mit Ausnahme der Behandlung mit aktiven D-Hormon-Metaboliten benötigt als Basistherapie Calcium und Vitamin D3. Bei Slow-Losern oder Non-Losern, deren Knochendichte nur mäßig erniedrigt sind, also bei Osteopenie oder beginnender Osteoporose, ist unter Umständen die alleinige Therapie mit Calcium und Vitamin D3 ausreichend, wobei die Dosisempfehlung 1000 – 1200 mg Calcium und 800 – 1000 I.E. Vitamin D3 ist. Zur Prophylaxe sind meist 500 – 600 mg Calcium und 400 – 500 I.E. Vitamin D3 ausreichend. Neue Studien zeigen signifikante Zunahmen der Knochendichte und deutliche Reduktionen der Frakturraten vor allem am Schenkelhals unter einer regelmäßigen Calcium-/Vitamin-D3-Supplementation bei postmenopausalen Frauen. Auch in eigenen Untersuchungen konnten wir signifikante Zunahmen der Knochendichte in der Spongiosa sowie eine deutliche Reduktion der alterstypischen Knochenmasseverluste in der Kompakta feststellen. Dabei war die Zunahme der Knochenmasse in der Spongiosa um so höher, je fortgeschrittener der vorangegangene Knochenverlust bereits ausgeprägt war, also vor allem bei schon fortgeschrittenen Osteoporosen. Dies zeigt, dass auch und gerade bei älteren Patienten Calcium und Vitamin D3 nicht nur immer noch sehr wirksam, sondern als Basistherapie unabdingbar sind. Dies bestätigen auch andere Untersuchungen, die bei über 60-jährigen Frauen und Männern in unseren Breitengraden deutlich erniedrigte Vitamin-Spiegel nachgewiesen haben! Ein Calcium-/Vitamin-D3-Mangel scheint daher in dieser Altersgruppe generell sehr verbreitet und eine wichtige (Mit)-Ursache bei der Entwicklung der Osteoporose zu sein. Zudem sind Calcium und Vitamin D3 billig und für jeden verfügbar und bei nahezu fehlenden Risiken hochwirksam, ohne das Arzneimittelbudget übermäßig zu belasten!
Fluoride für Slow-Loser-Patienten
Bei Slow-Loser-Patienten mit noch nicht allzu sehr erniedrigten Knochendichten kommen Fluoride in Frage. Fluoride stimulieren in niedriger Dosierung die Osteoblastensynthese, werden aber bei höherer Dosierung in das Kristallgitter des Knochens eingebaut, was zu Störungen der Knochenstruktur und sogar zu einer Zunahme der Frakturrate führen kann. Daher sollten Fluoride niedrig dosiert und eine Therapie mit täglich 10 – 20 mg bioverfügbarem Fluorid (entsprechend Natriummonofluorophosphat 75 – 150 mg oder Natriumfluorid 40mg) auf maximal drei bis vier Jahre beschränkt werden. Bei fortgeschrittenen Osteoporosen mit erheblichem Abbau der Trabekel sinkt die Chance für Neuvernetzungen, weshalb Fluoride dann nicht mehr geeignet sind. Im Gegensatz zu früheren Empfehlungen sollten Fluoride deshalb vor allem in nicht fortgeschrittenem Alter und nicht mit schwerer Osteoporose eingesetzt werden. Calcium (500 – 1000 mg tgl.) und Vitamin D3 (800 – 1000 I.E.) sollten in jedem Fall dazu gegeben werden.
Nebenwirkungen sind je nach Galenik Übelkeit und schmerzhafte Umbauzonen an mechanisch hochbelasteten Skelettabschnitten, z.B. an der distalen Tibia oder am Calcaneus, den Stellen ehemaliger Epiphysenfugen. Treten diese Schmerzen auf, sollte zunächst drei Monate mit der Therapie pausiert werden, dann kann ein erneuter Versuch mit niedrigerer Dosierung erfolgen. Bei zu langer Medikation oder bei zu hoher Dosierung kann es zu radiologisch erkennbaren Skelettverdichtungen (BWS seitlich) kommen. Diese bedeuten allerdings keinen Gewinn, sondern eher eine Reduktion der Stabilität. Wegen dieser Fluorose-Gefahr sollten unter Fluortherapie jährliche Röntgenaufnahmen der BWS (seitlich) gemacht werden.
Therapieversager (Non Responder) sind Patienten, die nicht mit einer Zunahme der Knochendichte reagieren. Andererseits ist z.B. bei einer Fluorose nicht jede Zunahme der Knochendichte als Therapieerfolg zu werten. Kontrainduziert sind Fluoride bei Patienten mit schnellem Knochenverlust. Hier müssen zunächst Antiresorptiva eingesetzt werden, allerdings können nach erfolgter Normalisierung des Knochenstoffwechsels im Anschluss daran bei noch nicht zu sehr fortgeschrittenen Osteoporosen Fluoride eingesetzt werden.
Antiresorptiv wirksame Osteoporosethrapeutika für Fast-Loser Patienten
· Östrogene
Die Hormonersatztherapie (HRT) wird außer bei hysterektomierten Frauen als Östrogen/Gestagen-Kombination verordnet. Sie ist die klassische Therapieform der frühpostmenopausalen Osteoporose. Östrogene bremsen den osteklastären Knochenabbau, im Mittel kommt es sogar zu einer leichten Zunahme der Knochenmasse, wohl über eine zusätzliche Osteoblastenstimulation. Ob Östrogene als Tabletten, Pflaster oder Gel angewendet werden, scheint für die Wirkung auf den Knochen keine entscheidende Rolle zu spielen. Dosierung und Präparatewahl sollten aber immer mit der Gynäkologin oder dem Gynäkologen abgestimmt werden, wobei die Dosierungen für eine ausreichende Knochenwirksamkeit bei konjugierten Östrogenen 0,625 mg, bei Östradiol 2 mg und bei Anwendung als Pflaster 0,05 mg/Tag betragen sollten. Prophylaktisch ist bei noch weitgehend intaktem Knochen unter Umständen auch die halbe Dosis in Kombination mit 500 – 1000 mg Calcium und ggf. Vitamin D3 ausreichend. Kontraindikationen wie Thrombosen oder Mamma-Ca müssen beachtet werden.
Eine Sonderform der HRT ist die Anwendung von Tibolon, das in Deutschland seit kurzem zugelassen ist. Die Dosierung weicht von dem klassischen Östrogen-/Gestagen-Schema ab, weil die Metabolite des Tibolons sowohl androgene, östrogene und gestagene Eigenschaften haben. Vorteile sind vor allem die annähernde Blutungsfreiheit und das seltenere Auftreten von Brustspannungen bei vergleichbaren Zunahmen der Knochendichten wie unter Östrogenen. Die Dosierung beträgt 2,5 mg/Tag.
· Selektive Estrogen Receptor Modulators – SERM´s
Raloxifen hat wie Tamoxifen antiöstrogene Eigenschaften, daneben aber auch östrogene Wirkungen durch unterschiedliche Beeinflussung der Östrogenrezeptoren. Wie die Östrogene hemmt auch Raloxifen den osteoklastären Knochenbau und wie bei Östrogenen und Tibolon kommt es im Mittel zu einer Zunahme der Knochendichten an der LWS und an der Hüfte. Auch die biochemischen Marker für den Knochenumsatz sinken unter Raloxifen im Mittel signifikant ab. Im Gegensatz zu Östrogenen und Tibolon ist für Raloxifen aber auch eine signifikante Reduktion des Risikos von Wirbelkörperfrakturen überzeugend nachgewiesen. Allerdings hat Raloxifen keine Wirkung auf die typischen klimakterischen Symptome wie Östrogene oder Tibolon.
Da Raloxifen keinen Effekt auf das Uterus-Endometrium hat, kommt es zu keinen Blutungen. Auch das Brustkrebsrisiko scheint unter Raloxifen sogar etwas abzusinken, weshalb der Einsatz von Raloxifen bei Frauen nach Brustkrebs diskutiert wird. Da die Studienergebnisse auf den Knochen unter einer kombinierten Therapie mit Raloxifen und Calcium/Vitamin D3 gewonnen wurden, ist bei der Therapie der postmenopausalen Osteoporose mit Raloxifen ebenfalls eine begleitende Calcium-/Vitamin-D3-Supplementation erforderlich. Die empfohlene Dosierung von Raloxifen liegt bei 60 mg täglich.
Zur Anwendung kommt Raloxifen zur Prophylaxe und Therapie der postmenopausalen Osteoporose und hier vor allem bei Frauen nach Brustkrebs oder mit Brustkrebsangst sowie bei Frauen, die keine Blutungen mehr tolerieren. Allerdings ist der breite Einsatz durch den deutlich höheren Preis gegenüber Östrogenen limitiert.
· Bisphosphonate
Derzeit sind zwei orale Bisphosphonate zur Therapie der Osteoporose zugelassen, Etidronat und Alendronat. Für Etidronat wird eine zyklische orale Therapie im Dreimonatsintervall empfohlen, jeweils 14 Tage 400 mg tgl., dann 76 Tage 500 mg Calcium täglich. Bei Einhaltung dieser Einnahmevorschriften gibt es in der Regel keine gravierenden Nebenwirkungen. Allerdings erscheint die Calciumdosis mit 500 mg etwas gering. Daneben gibt es Studien, die eine verbesserte Wirksamkeit von Etidronat unter zusätzlicher Vitamin-D3-Substitution zeigen, weshalb auch bei einer Therapie mit Etidronat eine kombinierte Calcium-/Vitamin-D3-Supplementation mit 500 – 1000 mg Calcium und 800 – 1000 I.E. Vitamin D3 vorzuziehen ist.
Alendronat wird kontinuierlich in einer Dosierung von 10 mg täglich verabreicht, wobei wegen des erhöhten Risikos ösophagogastrointestinaler Nebenwirkungen die Einnahmevorschriften strikt einzuhalten sind. Alendronat ist ein Aminobisphosphonat welches selektiv eine Art Schutzschicht vor allem unter der von Osteoklasten besetzten Knochenoberfläche zu bilden scheint und so den osteklastären Knochenabbau bremst. Auch unter Alendronat ist eine ausreichende Calciumsubstitution, am besten wieder in Kombination mit Vitamin D3 sicherzustellen!
Generell wurden unter einer Bisphosphonattherapie signifikante Zunahmen der Knochendichten an der LWS und an der Hüfte sowie eine deutliche Reduktion des Frakturrisikos für Wirbelkörper und am Schenkelhals beobachtet. Am deutlichsten scheint die Senkung des Risikos für Wirbelkörperfrakturen bei solchen Patienten zu sein, bei denen bereits mehrere Wirbelkörperfrakturen aufgetreten sind.
Daneben stehen heute auch Bisphosphonate zur zyklischen Anwendung als Infusion zur Verfügung, Ibandronat oder Pamidronat, welche besonders für Patenten mit eher schlechter Compliance von Vorteil sein können.
· D-Hormon-Metabolite
D-Hormon-Metabolite wie Alphacalcidol oder Calcitriol sind hochwirksame und vor allem für Osteoporose-Patienten mit schnellem Knochenmasseverlust (Fast-Losern) geeignete Substanzen. Empfohlen wird eine Dosierung von einem Mikrogramm Alphacalcidol oder 0,5 Mikrogramm Calcitriol täglich. Unter einer Therapie mit D-Hormon-Metaboliten kommt natürlich kein zusätzliches natives Vitamin D3 zum Einsatz, auf Calcium kann verzichtet werden bzw. bei einer calciumarmen Ernährung sollten maximal 500 mg Calcium zusätzlich gegeben werden, da sonst die Gefahr einer Hypercalciämie besteht. Daher sollten unter dieser Therapieform auch regelmäßige Kontrollen der Serumcalciumspiegel erfolgen.
Unter D-Hormon-Metaboliten wurde ebenfalls eine deutliche Hemmung der Knochenmasseverluste beobachtet, u.a. über eine Absenkung der Parathormonausscheidung aus den Nebenschilddrüsen. Außerdem wurde über Verbesserungen der Knochenqualität und Verbesserungen der neuromuskulären Koordination unter D-Hormon-Metaboliten berichtet.
· Calcitonin
Calcitonin kann subkutan oder nasal als Spray appliziert werden. Eine Standarddosierung ist z.B. 200 I.E. täglich nasal. Neben einem bremsenden Effekt auf den osteoklastären Knochenabbau hat Calcitonin auch eine analgetische Wirkung, die vor allem bei Patienten mit frischen Wirbelkörperfrakturen ausgenützt werden kann. Die analgetische Wirkung sollte etwa fünf bis acht Tage nach Behandlungsbeginn eintreten. Die Therapiedauer beträgt drei bis fünf Wochen, wobei typische Nebenwirkungen Flush und Übelkeit sind (eher bei subkutaner Applikation). Bei länger andauernder Anwendung kann es zur Antikörperbildung kommen, was dann zu einem Wirkungsabfall führen kann. Aufgrund des hohen Preises der nasalen Form ist eine langfristige Anwendung als Antiresorptivum wohl nur sehr begrenzt möglich.

Liebe Patientinnen, liebe Patienten,
Ich bin Professor Dr. Dietmar Daichendt, Ihr Experte auf dem Gebiet der Osteoporose und Knochengesundheit!
In meiner langjährigen Praxis habe ich mich darauf spezialisiert, Menschen mit Osteoporose die bestmögliche Behandlung und Betreuung zu bieten.
Mit meiner Privatpraxisklinik, die auf Ihre Bedürfnisse zugeschnitten ist, möchten wir sicherstellen, dass Sie sich bei uns wohl und gut aufgehoben fühlen. Wir legen Wert auf Barrierefreiheit, Komfort und höchsten Standard in der medizinischen Versorgung.
Ich stehe Ihnen gerne zur Verfügung, um Ihnen bei Fragen rund um Osteoporose und Knochengesundheit zu helfen. Vertrauen Sie auf meine Expertise und meine langjährige Erfahrung in der Behandlung dieser Erkrankung.
Ihr
Prof. Dr. med. Dietmar Daichendt