Risikofaktoren
Obwohl die Osteoporose eine multifaktorielle Krankheit ist, an deren Entstehung mehrere oder sogar zahlreiche Risikofaktoren beitragen, ist die eigentliche Ursache immer ein krankhaft erhöhter Knochenabbau.
Die einzelnen Risikofaktoren fördern oder bedingen diesen erhöhten Knochenabbau zwar in unterschiedlichem Ausmaß. Mit wenigen Ausnahmen (wie z.B. die durch länger andauernde Kortisoneinnahme bedingte Osteoporose) bewirkt aber ein einzelner dieser Risikofaktoren für sich allein in der Regel noch keine Osteoporose. So gibt es z.B. sicher keine „Kaffee-Osteoporose“, obwohl der Genuss von mehr als 4 Tassen Kaffee pro Tag in den meisten Ratgebern oder Abhandlungen zum Thema Osteoporose als Risikofaktor aufgeführt wird.
Osteoporose – eine Kinderkrankheit?
Nicht selten wird der Grundstein für eine spätere Osteoporose bereits in der Kindheit gelegt, wenn entweder aus erblichen Gründen oder durch eine zu calciumarme Ernährung bzw. durch Mangel an sportlicher Betätigung zu wenig Knochenmasse aufgebaut wird. Wieviel Knochenmasse überhaupt aufgebaut werden kann, ist ursprünglich genetisch festgelegt. Ob dieser genetische Plan tatsächlich eingehalten werden kann, ist dann u.a. stark von Ernährung und Bewegungsverhalten abhängig. Etwa zwischen dem 20. und 25. Lebensjahr ist der Aufbau dieser individuell unterschiedlichen Gipfelknochenmasse (englisch: peak-bone-mass) abgeschlossen. Je geringer diese ausfällt, um so höher ist das spätere Osteoporoserisiko, weil dann schon ein relativ geringer Knochenabbau oder Knochenmasseverlust ausreichen kann, um die Knochenmasse unter eine sog. Bruchschwelle (hohes Knochenbruchrisiko) absinken zu lassen.
Knochen ist ein höchst lebendiges und komplexes Gebilde. Zeitlebens wird unser Skelett ständig umgebaut und an die wechselnden Anforderungen des täglichen Lebens angepasst. Ist der Aufbau der individuell unterschiedlichen Spitzenknochenmasse erst einmal abgeschlossen, werden pro Jahr immerhin an die 5 – 10 Prozent des gesamten Knochens erneuert! Dabei wird dauernd „alter“ Knochen abgebaut und durch „neuen“ Knochen ersetzt. Das heißt, dass wir alle 10 bis 15 Jahre ein komplett neues Skelett aufgebaut haben. Dieser Umbau setzt sich bis ins hohe Lebensalter fort. Kann der Aufbau von neuem Knochen nicht mit dem vorangegangenen Knochenabbau Schritt halten, kommt es in der Summe zu einem Verlust von Knochensubstanz oder zu einem zunehmenden Knochenmasseverlust.
Trabekulärer und kortikaler Knochen
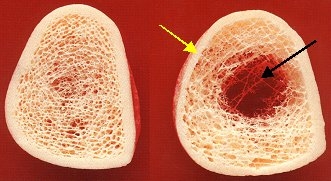
Dieser Knochenmasseverlust bewirkt vor allem eine Zerstörung derKnochenmikroarchitektur und zwar zunächst vorwiegend im trabekulären Knochen. Knochen besteht generell aus 2 unterschiedlichen Bausteinen, nämlich aus dem sog. trabekulären Knochen, einem komplexen 3-dimensionalen Bälkchennetzwerk und aus einem diesen umhüllenden kompakten Knochen, dem sog. kortikalen Knochen. Der kortikale Knochen weist eine wesentlich höhere Dichte auf als der trabekuläre Knochen (ca. 10x höher) und trägt deshalb deutlich mehr zur Gesamtknochenmasse bei. Außerdem unterscheiden sich die beiden Knochenbausteine erheblich im Stoffwechselverhalten und – wie auf dem folgenden Bild sichtbar – in ihrer Struktur. Das Bild zeigt die unterschiedlichen Strukturen des trabekulären und des kortikalen Knochens an einem gesunden (links) und an einem osteoporotischen Knochen (rechts). Bei dem osteoporotischen Knochen erkennt man ausgeprägte Zerstörungen der 3-dimensionalen Bälkchenstruktur (schwarzer Pfeil) und eine bereits deutlich verschmälerte Kortikalis (gelber Pfeil) im Vergleich zum gesunden Knochen mit noch völlig homogener und ungestörter Mikroarchitektur.
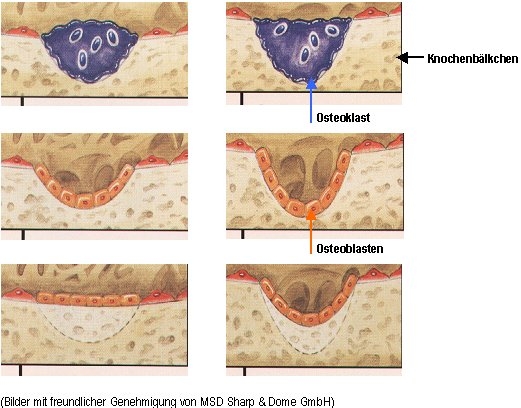 Zwei verschiedene Zellsysteme steuern diesen lebenslangen Knochenumbau, der auch als „Remodeling“ bezeichnet wird. Die Osteoklasten („Knochenfresser“) bauen alten Knochen ab, danach ersetzen Osteoblasten („Knochenbildner“) diesen wieder durch neue Knochen. Ein fein abgestimmtes und sensibles Gleichgewicht sorgt normalerweise dafür, dass schließlich wieder genauso viel Knochen aufgebaut wird wie vorher abgebaut wurde. Eine Störung dieser empfindlichen Balance mit mehr Abbau als Aufbau führt zur Osteoporose. Die 3 Bilder links zeigen einen normalen Remodelingzyklus, bei dem am Ende wieder der Anfangszustand erreicht ist. Der große blaue Osteoklast („knochenabbauende Zelle“, Bild oben) „frisst“ ein großes „Loch“ (Lakune) in das Knochenbälkchen, das danach durch viele kleine Osteoblasten („knochenaufbauende Zellen, orange, Bilder Mitte und unten) wieder vollständig aufgefüllt wird. Die 3 Bilder rechts zeigen den gleichen Vorgang bei der Osteoporose. Hier ist das „Loch“ (Lakune), welches der blaue Osteoklast in den Knochen „frisst“, größer (Bild oben) und die Osteoblasten können es nur noch unvollständig füllen (Bilder Mitte und unten). Am Ende des Zyklus bleibt ein Defekt. Im Skelett laufen ständig und zeitversetzt Millionen und aber Millionen dieser Zyklen ab, die jeweils ca. 120 Tage dauern.
Zwei verschiedene Zellsysteme steuern diesen lebenslangen Knochenumbau, der auch als „Remodeling“ bezeichnet wird. Die Osteoklasten („Knochenfresser“) bauen alten Knochen ab, danach ersetzen Osteoblasten („Knochenbildner“) diesen wieder durch neue Knochen. Ein fein abgestimmtes und sensibles Gleichgewicht sorgt normalerweise dafür, dass schließlich wieder genauso viel Knochen aufgebaut wird wie vorher abgebaut wurde. Eine Störung dieser empfindlichen Balance mit mehr Abbau als Aufbau führt zur Osteoporose. Die 3 Bilder links zeigen einen normalen Remodelingzyklus, bei dem am Ende wieder der Anfangszustand erreicht ist. Der große blaue Osteoklast („knochenabbauende Zelle“, Bild oben) „frisst“ ein großes „Loch“ (Lakune) in das Knochenbälkchen, das danach durch viele kleine Osteoblasten („knochenaufbauende Zellen, orange, Bilder Mitte und unten) wieder vollständig aufgefüllt wird. Die 3 Bilder rechts zeigen den gleichen Vorgang bei der Osteoporose. Hier ist das „Loch“ (Lakune), welches der blaue Osteoklast in den Knochen „frisst“, größer (Bild oben) und die Osteoblasten können es nur noch unvollständig füllen (Bilder Mitte und unten). Am Ende des Zyklus bleibt ein Defekt. Im Skelett laufen ständig und zeitversetzt Millionen und aber Millionen dieser Zyklen ab, die jeweils ca. 120 Tage dauern.
Aufgabe dieses Remodelings ist es, den Knochen stabil zu halten und fortwährend an die wechselnden Anforderungen des täglichen Lebens anzupassen. Eine Störung des Gleichgewichtes der Aktivität dieser beiden Zellsysteme – Osteoklasten und Osteoblasten – führt zu einem erhöhten Knochenmasseverlust.
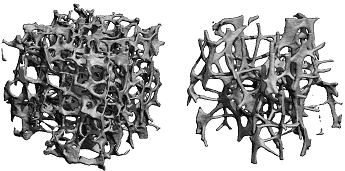
Von dem osteoporotischen Knochenmasseverlust betroffen ist zunächst hauptsächlich dertrabekuläre Knochen. Dies liegt vor allem an dessen voluminöser und verzweigter Struktur mit sehr hoher Knochenoberfläche im Vergleich zu dem sehr dichten kortikalen Knochen mit sehr viel geringerer Knochenoberfläche. Daher führt der Knochenmasseverlust schon frühzeitig zu einer Zerstörung besonders der trabekulären Knochenstruktur mit fortschreitender Destruktion und schließlich völliger Auflösung der Knochenbälkchen (Trabekel). Die folgende Abbildung der trabekulären Mikroarchitektur zeigt das Prinzip dieser Strukturzerstörung bei einem gestörten Remodeling mit erhöhter Aktivität der knochenabbauenden Zellen (Osteoklasten).
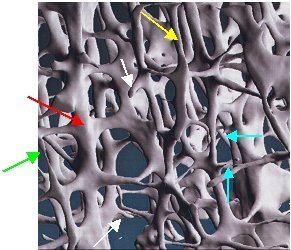
Sehr schön zu erkennen ist hier, wie die ursprünglich sehr dicken Bälkchen (roter Pfeil) immer dünner (gelber Pfeil) und schließlich ganz dünn (grüner Pfeil) werden, bis sie letztlich durchbrechen (blaue Pfeile) und am Ende bis auf kleine Reststümpfe verschwunden sind (weiße Pfeile). Betroffen sind zunächst vor allem die horizontalen Bälkchen. Die Folge ist eine erhöhte Bruchanfälligkeit. (Bild: Mirko-CT-Aufnahme, mit freundlicher Genehmigung Fa. Scanco Medical AG, Zürich, Schweiz)
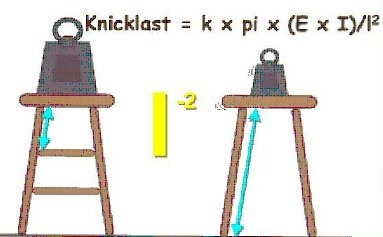 Erst der Strukturverlust bzw. die Strukturzerstörung als Folge des beschleunigten Knochenmasseverlustes bedingt letztlich das erhöhte Knochenbruchrisiko. Am frühesten von dieser Zerstörung betroffen sind dabei die zarten Knochenbälkchen des trabekulären Knochens und hier zuerst meist die horizontalen bzw. quer verlaufenden Trabekel. Wie das bildlich dargestellte Beispiel des Barhockers eindrucksvoll zeigt, nimmt die Belastbarkeit allein durch den Wegfall der Querstreben erheblich ab, trotz ansonsten noch unbeschädigter Stuhlbeine. Es reicht also bereits eine deutlich kleinere Last (Knicklast) aus, um den Hocker zum Einsturz zu bringen, indem die Stuhlbeine auseinandergedückt werden. Das gleiche Prinzip führt auch beim Knochen zur erhöhten Brüchigkeit (Abbildung: Prof. Felsenberg, Berlin).
Erst der Strukturverlust bzw. die Strukturzerstörung als Folge des beschleunigten Knochenmasseverlustes bedingt letztlich das erhöhte Knochenbruchrisiko. Am frühesten von dieser Zerstörung betroffen sind dabei die zarten Knochenbälkchen des trabekulären Knochens und hier zuerst meist die horizontalen bzw. quer verlaufenden Trabekel. Wie das bildlich dargestellte Beispiel des Barhockers eindrucksvoll zeigt, nimmt die Belastbarkeit allein durch den Wegfall der Querstreben erheblich ab, trotz ansonsten noch unbeschädigter Stuhlbeine. Es reicht also bereits eine deutlich kleinere Last (Knicklast) aus, um den Hocker zum Einsturz zu bringen, indem die Stuhlbeine auseinandergedückt werden. Das gleiche Prinzip führt auch beim Knochen zur erhöhten Brüchigkeit (Abbildung: Prof. Felsenberg, Berlin).
Die Querstreben halten die Stuhlbeine praktisch zusammen. Fallen diese weg, „rutschen“ die Stuhlbeine schon bei einer viel geringeren Belastung – dargestellt durch die beiden Gewichte – auseinander und lassen den Barhocker in sich zusammensinken. Auf den rechten Barhocker dürfte sich also allenfalls ein sehr leichtgewichtiger Gast setzen.
Am Ende des Knochenmasseverlustes steht die Zerstörung der Knochenmikroarchitektur mit erhöhter Knochenbrüchigkeit. Je geringer dabei die ursprünglich aufgebaute Knochenmasse war und je schneller der spätere Knochenmasseverlust ist bzw. je länger dieser Abbau andauert, um so eher kommt es zur Ausbildung einer Osteoporose. Die Ursachen für den erhöhten Knochenabbau sind vielfältig (siehe Risikofaktoren), letztlich ist es aber immer der erhöhte Knochenmasseverlust, der zur Osteoporose führt!
Die beiden Abbildungen zeigen im Vergleich einen gesunden Knochen links mit regelmäßiger und normaler Bälkchenstruktur (Mikroarchitektur) und rechts das Endresultat, einen schon deutlich osteoporotischen Knochen mit erheblich reduzierter Bälkchenstruktur und erhöhtem Knochenbruchrisiko (Bilder: Mirko-CT-Aufnahmen, mit freundlicher Genehmigung Fa. Scanco Medical AG, Zürich, Schweiz).
Die Steuerung bzw. Regulation der Aktivität der beiden Zellsysteme Osteoklasten und Osteoblasten im Rahmen des Remodelings erfolgt einerseits durch verschiedene Hormone (u.a. Östrogene, Testosteron, Parathormon, Calcitonin) sowie andererseits durch körperliche Belastung. Einige der knochenbildenden Zellen (Osteoblasten) werden am Ende eines Remodelingzyklus in spezielle Knochenzellen – Osteozyten – umgewandelt, die in den neugebildeten Knochen eingebaut werden. Diese Osteozyten sind durch lange Zellausläufer – ähnlich dem neuronalen Netzwerk der Nervenzellen – untereinander verbunden und werden sowohl durch körperliche Belastung (Bewegung, Sport) als auch durch Hormone aktiviert. Diese stimulieren dann den Knochenumbau im Prozess des Remodelings bzw. regen neue Remodelingzyklen an. Daneben spielen vor allem Calcium und Vitamin D3während des gesamten Lebens eine zentrale Rolle im Remodeling: im Kindes- und Jugendalter zum Aufbau des Skelettes, beim Erwachsenen und vor allem beim älteren Menschen zur Vermeidung eines übermäßigen Knochenmasseverlustes.
Calcium ist das Baumaterial des Knochens und als solches das mengenmäßig mit Abstand wichtigste Mineral im Körper. Calcium ist aber ebenso unentbehrlich für eine ungestörte Muskeltätigkeit – sowohl der Herzmuskel als auch die Skelettmuskulatur funktionieren nur auf Basis der Calcium-Muskelpumpe – sowie als Kofaktor für eine Vielzahl enzymatischer Reaktionen. Das Skelett dient somit neben seiner eigentlichen Funktion für den Stütz- und Bewegungsapparat auch als Calciumspeicher für den Organismus. Da ein stärkeres Absinken des Calciumblutspiegels eine lebensbedrohliche Situation darstellt, ist der Organismus bestrebt, diesen stets innerhalb enger Grenzen zu halten. Droht der Calciumblutspiegel (z.B. bei zu geringer Calciumzufuhr aufgrund calciumarmer Ernährung) abzusinken, verfügt der Organismus über effektive Maßnahmen zur Gegenregulation. In den Nebenschilddrüsen wird dann verstärkt Parathormon gebildet und ausgeschüttet, welches bewirkt, dass Calcium aus dem Knochen mobilisiert wird. Damit wird die ausreichende Calciumversorgung der für die Vitalfunktionen wichtigeren Organe (Herz, Muskel) sichergestellt, allerdings auf Kosten des Knochens.
Damit das Calcium im Darm auch in ausreichenden Mengen aufgenommen werden kann, ist Vitamin D3 notwendige Voraussetzung. Ist zu wenig Vitamin D3 vorhanden, kann selbst bei theoretisch ausreichender Calciumzufuhr ein Calciummangel entstehen. Beim Kind führt der Mangel an Vitamin D3 zur Rachitis (englische Krankheit mit „weichen“ Knochen), beim älteren Menschen zur Osteoporose. Normalerweise wird Vitamin D3 unter dem Einfluss der Sonne (UV-B-Anteil) in der Haut vom Körper selbst hergestellt, doch lässt diese Fähigkeit mit zunehmendem Alter deutlich nach. Vor allem diese nachlassende Fähigkeit Vitamin D3 zu produzieren, ist der Grund, dass ca. 80% der über 60-jährigen einen Mangel an Vitamin-D3 aufweisen. Eine große europäische Studie hat kürzlich gezeigt, dass die Vitamin-D-Spiegel im Blut gerade in den südlichen Ländern wie Griechenland, Italien und Spanien die niedrigsten in ganz Europa waren, während in den Nordländern (Norwegen, Finnland, Schweden) signifikant höhere Vitamin-D-Spiegel gefunden wurden. Grund dafür dürften die mit Vitamin-D3 angereicherten Nahrungsmittel sein, die in diesen Ländern weit verbreitet sind. Offensichtlich reicht Sonnenlicht alleine nach dem 50. Lebensjahr gemäß diesen neuen Erkenntnissen und entgegen der immer noch weit verbreiteten Meinung also meist doch nicht aus, um eine ausreichende Versorgung mit Vitamin D3 zu gewährleisten.
Sekundärer Hyperparathyreoidismus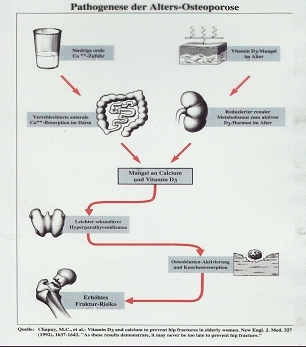
Folge des Calcium-/Vitamin-D-Mangels beim älteren Menschen ist der sog. sekundäre Hyperparathyreoidismus. Da insgesamt zu wenig Calcium im Körper ankommt, wird in der Nebenschilddrüse vermehrt Parathormon gebildet und dadurch dem Knochen ständig Calcium entzogen, um ein Absinken des Calciumspiegels im Blut zu verhindern. Die erhöhte Ausschüttung von Parathormon aus den Nebenschilddrüsen führt zu einem dauerhaft erhöhten Parathormonspiegel – deshalb die Bezeichnung Hyperparathyreoidismus. Genauer gesagt handelt es sich hier um einen sekundären Hyperparathyreoidismus, weil dieser eine Folge der zu geringen Calciumaufnahme ist. Entscheidende Konsequenz ist letztlich der anhaltend erhöhte Knochenabbau, der schließlich zur Osteoporose führt.
Entwicklung der sog. Altersosteoporose aufgrund eines sekundären Hyperparathyreoidismus:
Sowohl die niedrige Calciumzufuhr als auch der Vitamin-D-Mangel im Alter führen zu einer Verschlechterung der Calciumaufnahme im Darm. Außerdem lässt im Alter die Fähigkeit der Niere, das Vitamin D3 in das aktive sog. D-Hormon umzuwandeln, nach. Folge ist ein Mangel an Calcium und Vitamin D, was zu einer vermehrten Ausschüttung des Nebenschilddrüsenhormons (Parathormon) führt. Dieses Parathormon aktiviert die knochenabbauenden Zellen (Osteoklasten), was einen erhöhten Knochenabbau und eine Zunahme des Knochenbruchrisikos (Osteoporose) bewirkt. (Schema nach Chapuy, M.C.)
Die weiblichen Hormone – die Östrogene – spielen ebenfalls eine wichtige Rolle bei der Regulation des Knochenumbaus (Remodeling). Sie dienen als eine Art Bremse für die Osteoklasten, die knochenabbauenden Zellen. Die Östrogene werden in den Eierstöcken gebildet und sind zunächst wichtig für den endgültigen Aufbau der Spitzenknochenmasse ab der Pubertät und danach für den Erhalt der Knochenmasse bis zur Menopause (letzte natürliche Regelblutung). Ein verspäteter Beginn der Eierstockfunktion (erkennbar an einer späten ersten Regelblutung – Menarche – nach dem 16. Lebensjahr) kann zu einem verminderten Knochenaufbau führen und ist daher mit einem höheren Osteoporoserisiko verbunden. Das Versiegen der Eierstockfunktion nach der Menopause ist ein Grund, warum Frauen in diesem Lebensabschnitt besonders häufig betroffen sind, weil die Bremswirkung dann schon früher ausfällt. Daher sind sowohl eine frühzeitige Menopause als auch die operative Entfernung der Eierstöcke vor dem 45. Lebensjahr mit einem deutlich höhereren Osteoporoserisiko verbunden. Eine Hormonbehandlung nach der Menopause kann einen übermäßigen Knochenabbau zwar oft verhindern, jedoch sind Östrogene wegen des erhöhten Brustkrebsrisikos zunehmend in die Kritik geraten und daher nicht mehr uneingeschränkt zu empfehlen. Zur Behandlung einer manifesten Osteoporose zählen Östrogene heute definitiv nicht mehr zu den Mitteln der ersten Wahl bzw. sind dafür nach heutigem Kenntnisstand nicht mehr ausreichend.
Beim Mann hat das Testosteron – das männliche Sexualhormon – eine den Östrogenen vergleichbare Aufgabe. Allerdings gibt es beim Mann keine Menopause in dem Sinn wie bei der Frau, obwohl auch die Testosteronbildung in den Hoden mit zunehmendem Lebensalter nachlässt. U.a. deshalb tritt die Osteoporose beim Mann seltener auf. Neuere Erkenntnisse weisen aber darauf hin, dass auch beim männlichen Geschlecht weibliche Hormone – Östrogene – im Stoffwechsel eine gewisse Bedeutung haben und auch beim Mann ein Östrogenmangel anscheinend an der Ausbildung einer Osteoporose mit beteiligt sein könnte.
Neben Hormonen, Calcium und Vitamin D ist auch die Bewegung maßgeblich an der Regulation des Remodelings beteiligt – und zwar über die schon erwähnten Osteozyten, die umgewandelten knochenaufbauenden Zellen (Osteoblasten), die im Rahmen eines Remodelingzyklus in den Knochen eingebaut werden. Tatsächlich scheint ein echter Knochenaufbau nur über eine Belastung des Knochens durch die Muskulatur möglich zu sein. Diese „Osteozyten“ fungieren nach derzeitigen Erkenntnissen als eine Art Bewegungsmelder und stimulieren über die Registrierung von Vibrationen sowie Zug und vor allem Druck letztlich den Knochenaufbau. Entfallen diese Reize aufgrund von zu wenig Bewegung (Sport) oder ganz besonders bei Immobilisierung, beispeilsweise durch Bettlägerigkeit, werden nur die knochenabbauenden Zellen (Osteoklasten), nicht hingegen die knochenaufbauenden Zellen (Osteoblasten) aktiviert. Die Folge ist ein erhöhterKnochenmasseverlust. Dies wurde sehr anschaulich z.B. bei Astronauten in der Schwerelosigkeit nachgewiesen, wo es aufgrund der fehlenden Belastung des Skeletts durch das nicht mehr vorhandene Körpergewicht sehr rasch zu ausgeprägten Knochenmasseverlusten kommt.
